- Untuk mempelajari transisi dari fisika klasik ke teori kuantum
- Untuk mempelajari teori Bohr untuk spektrum emisi atom hidrogen
Kawat Uji

Pembakar Bunsen

B. Bahan
Natrium

Upaya awal oleh fisikawan abad ke-19 untuk memahami atom dan molekul bertemu dengan kesuksesan hanya terbatas. Dengan asumsi bahwa molekul berperilaku seperti rebound bola, fisikawan mampu memprediksi dan menjelaskan beberapa fenomena makroskopis, seperti tekanan yang diberikan oleh gas. Dapat diartikan bahwa gaya yang menahan atom tidak bisa dijelaskan bersama. Butuh waktu lama untuk menyadari dan menerimanya.
Era baru dalam fisika dimulai pada tahun 1900 dengan seorang fisikawan muda Jerman bernama Max Planck. Pada suhu tertentu, Planck menemukan bahwa atom dan molekul hanya memancarkan energi kuantitas diskrit tertentu atau kuanta. Memang, kesibukan penelitian yang kemudian mengubah konsep alam kita selamanya.
Sifat Gelombang
Gelombang memiliki ciri-ciri yaitu panjang dan tingginya serta jumlah gelombang yang melewati titik tertentu per detik. Selain itu gelombang memiliki satu sifat penting yaitu kecepatan yang bergantung pada jenisnya gelombang dan sifat media yang dilalui gelombang tersebut.
Kecepatan gelombang ( v ) adalah hasil kali panjang gelombang ( λ ) dan frekuensinya ( f ).
A B
Radiasi Elektromagnetik
Medan listrik dan komponen medan magnet dari gelombang elektromagnetik. Kedua komponen ini memiliki panjang gelombang , frekuenesi, dan amplitudo, tetapi mereka berosilasi menjadi dua bidang yang saling tegak lurus.
Arti penting dari teori Maxwell adalah ini memberikan deskripsi matematis tentang perilaku umum cahaya, khususnya lar, modelnya secara akurat menggambarkan bagaimana energi dalam bentuk radiasi bisa disebarkan melalui ruang sebagai medan listrik dan magnet yang bergetar. Radiasi elektromagnetik adalah emisi dan transmisi energi dalam bentuk gelombang elektromagnetik.
Didalam ruang hampa gelombang elektromagnetik bergerak 3,00 × 10^8 m/s (dibulatkan) atau sekitar 186.000 mil/s. Kecepatan ini berbeda dari satu medium ke medium lainnya. Kecepatan gelombang elektromagnetik atau biasa disebut kecepatan cahaya biasa dilambangkan dengan c. Satuan dari panjang gelombang elektromagnetik biasanya diberikan dalam nanometer (nm).
Maka dari hal tersebut didapati rumus kecepatan cahaya yaitu
Dari gambar diatas menunjukkan berbagai jenis radiasi elektromagnetik yang berbeda dari satu sama lain dalam panjang gelombang dan frekuensi. Gelombang yang paling pendek memiliki frekuensi tertinggi, dikaitkan dengan sinar γ (gamma) yang dihasilkan dari perubahan dalam inti atom. Dan dapat kita lihat semakin tinggi frekuensinya, semakin besar energi radiasinya. Jadi, radiasi ultraviolet, sinar X, dan sinar γ memiliki energi radiasi yang tinggi.
Teori Kuantum Planck
Pada tahun 1900, seorang fisikawan asal Jerman, Max Planck muncul dengan gebrakan baru yang menjadi awal munculnya fisika modern. Planck mampu menjelaskan permasalahan bencana ultraviolet yang sebelumnya tidak mampu dijelaskan oleh ilmuwan-ilmuwan lainnya.
Menurut Planck, radiasi elektromagnetik yang dipancarkan suatu benda terbagi-bagi, atau diskret ke dalam paket-paket energi yang disebut Kuantum. Besarnya energi ini bergantung pada besarnya frekuensi gelombang elektromagnetik. Planck menjelaskan teorinya ini dengan rumus matenatik berikut.
Teori Planck ini mampu menjelaskan bencana ultraviolet. Hasil perhitungan dengan persamaan Planck ini ternyata sama dengan hasil eksperimen sebelumnya. Mereka menjukkan grafik pengamatan benda hitam dengan pola yang sama.
Teori Planck kemudian lebih dikenal sebagai Teori Kuantum dana mengawali peralihan fisika klasik menuju fisika modern. Teori Planck juga menginspirasi banyak ilmuwan terhadap berbagai pandangan baru, salah satunya mengenai cahaya.
7.2 Efek Fotolistrik
Pada tahun 1905, Albert Einstein menggunakan teori untuk memecahkan misteri lain dalam fisika, efek fotolistrik, sebuah fenomena dimana elektron dikeluarkan dari permukaan logam tertentu yang terbuka untuk menerangi setidaknya frekuensi minimum tertentu, yang disebut frekusiensi ambang. Jumlah electron yang dikeluarkan sebanding dengan intensitas cahaya, tetapi energi elektron yang dikeluarkan tidak. Dibawah frekuensi ambang tidak ada elektron yang dikeluarkan tidak peduli seberapa kuat cahayanya.
Efek fotolistrik tidak dapat dijelaskan oleh teori gelombang cahaya. Bagaimanapun Einstein membuat asumsi yang luar biasa. Partikel cahaya yang sekarang disebut foton menggunakann teori radiasi kuantum Planck sebagai titik awal. Einstein menyimpulkannya setiap foton harus memiliki energy E, yang diberikan persamaan.
Jadi kesimpulannya adalah semakin itinggi intens cahayanya, semakin besar jumlah elektron yang dipancarkan oleh logam, dan semakin tinggi frekuensi cahaya, semakin besar energi kinetik dari elektron yang dikeluarkan.
Teori cahaya Einstein menimbulkan dilemma bagi para ilmuwan. Di satu sisi, itu menjelaskan efek fotolistrik dengan memuaskan. Di sisi lain, partikel teori cahaya tidak konsisten dengan perilaku gelombang cahaya yang diketahui. Satu-satunya cara untuk menyelesaikan dilemma ini adalah dengan menerima gagasan bahwa cahaya memiliki kedua partikel seperti dan properti seperti gelombang. Bergantung pada eksperimen, cahaya berperilaku sebagai gelombang atau sebagai aliran partikel. Konsep ini, yang disebut dualitas gelombang partikel benar-benar asing bagi cara berpikir fisikawan tentang materi dan radiasi, dan itu butuh waktu lama bagi mereka untuk menerimanya.
7.3 Teori Bohr tentang Atom Hidrogen
Spektrum Emisi
Spektrum emisi atau spektrum pancar adalah spektrum radiasi (elektromagnetik) kontinu ataupun garis yang dipancarkan oleh zat. Agar dapat melihat spektrum emisi kita perlu memberi energi pada sampel material, baik dengan energi panas maupun dengan energi lain. Perhatikanlah gambar berikut untuk memahami lebih lanjut.
Spektrum Emisi Atom Hidrogen
Bohr mendalilkan bahwa electron hanya diizinkan untuk menempati orbit tertentu pada energi tertentu (elektron dikuantisasi). Sehingga elektron yang berada di dalam orbit tidak akan berputar ke inti sehingga tidak akan memancarkan energi. Bohr mengaitkan emisi radiasi oleh atom hidrogen yang berenergi kepada elektron yang jatuh dari orbit yang tinggi ke orbit yang lebih rendah sehingga memancarkan kuantum energi (foton) dalam bentuk cahaya (Gambar 1.4). Sedangkan jika elektron berpindah dari orbit rendah ke orbit yang lebih tinggi menyebabkan penyerapan energi radiasi oleh atom.
yang mana RH, konstanta Rydberg untuk atom hidrogen, memiliki nilai 2,18 X 10⁻¹⁸ J. Angka n adalah bilangan bulat yang disebut bilangan kuantum utama; ini memiliki nilai n = 1, 2, 3, dst. Sedangkan Tanda negatif dalam rumus adalah konvensi arbitrer, yang menandakan energi elektron dalam atom lebih rendah dari energi elektron bebas (E∞ = 0) , yang merupakan elektron yang jauh dari inti. Ketika elektron semakin dekat ke inti), En menjadi lebih negative. Nilai yang paling negatif saat berada pada keadaan dasar (n=1). Elektron hidrogen yang n lebih besar dari 1 dikatakan dalam keadaan tereksitasi. Jari-jari setiap orbit melingkar dalam model Bohr tergantung pada n². Jadi, ketika n bertambah dari 1 menjadi 2 menjadi 3, jari-jari orbit meningkat dengan sangat cepat. Semakin tinggi keadaan tereksitasi, semakin jauh elektron dari inti.
Penerapan gambar 1.8 pada proses emisi,jatuhnya elektron dari orbit tinggi ke orbit rendah, sehingga perbedaan energi pada kondisi awal (i) dan akhir (f) adalah :
∆E = Ef - Ei
yang mana dari gambar 1.8 menghasilkan :
Tabel 7.1 Berbagai Seri dalam Spektrum Emisi Atom Hidrogen
Seri | nf | ni | Wilayah spektrum |
Lyman | 1 | 2, 3, 4, ... | Ultraviolet |
Balmer | 2 | 3, 4, 5, ... | Cahaya tampak dan ultraviolet |
Paschen | 3 | 4, 5, 6, ... | Inframerah |
Brackett | 4 | 5, 6, 7, ... | Inframerah |
7.4 Sifat Dualisme Elektron
Gambar 2.1 Setiap titik mewakili sebuah simpul. Panjang string (𝝀) harus sama dengan bilangan bulat total satu setengah panjang gelombang (𝝀/2).
Jika sebuah elektron berperilaku seperti gelombang stasioner dalam atom hidrogen, panjang gelombang harus sesuai dengan keliling orbit dengan tepat, kalau tidak, sebagian gelombang akan membatalkan sendiri pada setiap orbit berurutan yang menyebabkan amplitudo gelombang akan dikurangi menjadi nol, dan gelombang tidak akan ada.
Gambar 2.2 (a) Lingkar orbit sama dengan jumlah panjang gelombang yang tidak terpisahkan (orbit yang diizinkan) (b) Lingkar orbit tidak sama dengan jumlah panjang gelombang integral (orbit yang tidak diizinkan) menyebabkan gelombang elektron tidak menutup dengan sendirinya.
Hubungan antara keliling orbit yang diizinkan (2𝝅r) dan panjang gelombang (𝝀) elektron diberikan oleh:
Ket : r = jari jari orbit
𝝀 = Panjang gelombang dari gelombang elektron.
De Broglie menyimpulkan bahwa partikel dan sifat gelombang terkait dengan ekspresi :
Ket : 𝝀 =panjang gelombang yang terkait dengan partikel yang bergerak
m= massa
u= kecepatan.
Setelah de Broglie memperkenalkan persamaannya, Clinton Davisson dan Lester Germer di Amerika Serikat dan G. P. Thomson di Inggris menunjukkan bahwa elektron memang memiliki sifat mirip gelombang. Dengan mengarahkan seberkas elektron melalui selembar kertas emas tipis, Thomson memperoleh satu set cincin konsentris pada layar, mirip dengan pola yang diamati ketika sinar X (yang merupakan gelombang) digunakan.
Gambar 2.4 (a) pola difraksi sinar-X dari aluminium foil. (b) Difraksi elektron aluminium foil. Kesamaan kedua pola ini menunjukkan bahwa elektron dapat berperilaku seperti sinar X dan menampilkan sifat gelombang.
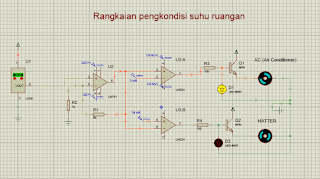
Rangkaian suhu LM35 setelah dijalankan :
Gambar rangkaian simulasi saat temperatur antara 16 - 30 derajat Celcius (Motor dalam keadaan OFF)
Gambar rangkaian simulasi ketika mencapai suhu < 16






























No comments:
Post a Comment